Amphetamin: Drogenprofil

Über Amphetamin
Eine synthetische Substanz. Normalerweise ein weißes Pulver, das das zentrale Nervensystem (ZNS) stimuliert. Amphetamin wurde vermutlich erstmals in den 1880er Jahren vom deutschen Chemiker Leuckart hergestellt, jedoch ist dies nicht nachweisbar. Augenscheinlich wurde die Chemie von Amphetamin, wie die von Methamphetamin, erst Anfang des zwanzigsten Jahrhunderts systematisch untersucht. Amphetamin hat einen begrenzten therapeutischen Nutzen, wird aber größtenteils in illegalen Labors in Europa hergestellt. Es steht unter internationaler Kontrolle und ist eng verwandt mit Methamphetamin.
Chemie
Amphetamin (CAS-300-62-9) gehört zur Familie der Phenethylamine, der zahlreiche Substanzen angehören, die als Stimulantien, entaktogen oder halluzinogen wirken können. Amphetamin ist das N,α-Methylphenethylamin. Der volle systematische Name gemäß der Nomenklatur der IUPAC ist N,α-Methylbenzolethanamin. Das asymmetrische α-Kohlenstoffatom verursacht zwei Enantiomere. Diese beiden Formen wurden früher als [–]- oder l-Stereoisomer bzw. [+]- oder d-Stereoisomer bezeichnet, sind jedoch in der modernen Chemie als R- und S-Stereoisomere definiert.
Molekülstruktur
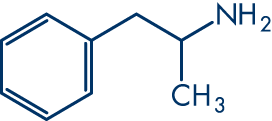
Molekülformel: C9H13N
Molekulargewicht: 135.2
Physische Form
Amphetamin-Base ist ein farbloses, flüchtiges und in Wasser unlösliches Öl. Das gängigste Salz ist das Sulfat (CAS-60-13-9): ein in Wasser lösliches weißes oder cremeweißes Pulver. Illegale Produkte haben meist Pulverform. Tabletten, die Amphetamin enthalten, können Logos tragen, wie man sie ähnlich auf MDMA und anderen Ecstasy-Tabletten findet.
Pharmakologie
Amphetamin ist ein Stimulans des zentralen Nervensystems, das Hypertonie und Tachykardie zusammen mit Gefühlen erhöhter Zuversicht, Geselligkeit und Energie auslöst. Es unterdrückt Appetit und Müdigkeit und führt zu Schlaflosigkeit. Nach oraler Anwendung setzt die Wirkung meist binnen 30 Minuten ein und hält mehrere Stunden lang an. Später können sich die Anwender reizbar, unruhig, ängstlich, deprimiert und lethargisch fühlen. Die Substanz steigert die Wirkung der Neurotransmitter-Systeme für Noradrenalin und Dopamin. Amphetamin hat eine geringere Potenz als Methamphetamin, jedoch sind die Wirkungen in unkontrollierten Situationen kaum unterscheidbar. Das S-Isomer wirkt stärker als das R-Isomer. Es wird nach oraler Aufnahme schnell absorbiert. Nach einer einzigen oralen Dosis von 10 mg liegen die Höchstwerte im Blutplasma bei etwa 0,02 mg/l. Die Plasma-Halbwertszeit schwankt zwischen 4 und 12 Stunden und hängt vom pH des Urins ab: bei alkalischem Urin geht die Ausscheidungsrate zurück. Ein wichtiger Metabolit ist 1-Phenyl-2-propanon, mit 4-Hydroxyamphetamin in geringeren Mengen. Die Analyse von Amphetamin im Urin wird dadurch kompliziert, dass es auch Metabolit von Methamphetamin sowie einiger anderer Arzneimittel ist. Akute Intoxikation verursacht schwere kardiovaskuläre Störungen und auch Verhaltensprobleme mit Erregtheit, Verwirrung, Paranoia, Impulsivität und Gewalttätigkeit. Chronischer Gebrauch von Amphetamin verursacht neurochemische und neuroanatomische Veränderungen. Abhängigkeit – die sich an erhöhter Toleranz gegenüber der Substanz zeigt – führt zu Beeinträchtigungen der Merkfähigkeit, der Entscheidungsfreude und der mündlichen Ausdrucksfähigkeit. Einige der Symptome ähneln denen der paranoiden Schizophrenie. Diese Wirkungen können auch nach Anwendung der Droge noch anhalten, verschwinden meist aber schließlich. Bei Injektion von Amphetamin besteht die gleiche Gefahr einer Virusinfektion (z.B. HIV und Hepatitis) wie bei anderen injizierbaren Drogen wie Heroin. Todesfälle, die direkt auf Amphetamin zurückgeführt werden können, sind selten. Die geschätzte letale Mindestdosis liegt bei nicht abhängigen Erwachsenen bei 200 mg.
Synthese und Vorläufersubstanzen
Die Synthese erfolgt meist nach dem Leuckart-Verfahren. Dabei wird aus 1-Phenyl-2-propanon (P2P, BMK, Phenylaceton) und Reagenzien wie Ameisensäure, Ammoniumformiat oder Formamid eine racemische Mischung der R- und S-Enantiomere hergestellt. Ein deutlich seltener genutztes, aber stereoselektives Verfahren beruht auf der Reduktion der entsprechenden Diastereoisomere von Norephedrin oder Norpseudoephedrin. Diese Vorläufersubstanzen (1-Phenyl-2-propanon, Norephedrin und Norpseudoephedrin) sind aufgeführt in Tabelle I des Übereinkommens der Vereinten Nationen von 1988 zur Bekämpfung des illegalen Handels mit Suchtstoffen und psychotropen Substanzen. Die entsprechende EU-Gesetzgebung beruht auf der Verordnung (EWG) Nr. 3677/90 des Rates (mit späteren Änderungen), die den Handel zwischen der EU und Drittländern reguliert.
Anwendung
Amphetamin kann geschluckt, geschnupft und seltener auch injiziert werden. Im Gegensatz zum Hydrochloridsalz von Methamphetamin ist Amphetaminsulfat nicht ausreichend flüchtig, um geraucht werden zu können. Bei oraler Aufnahme kann eine Dosis, je nach Reinheit, einige zehn bis zu mehrere hundert Milligramm betragen.
Andere Namen
Der Begriff Amphetamin (Internationaler Freiname INN) bezieht sich auf eine racemische Mischung der beiden Enantiomere. Der Name Amphetamin wird auch durch die Richtlinien 65/65/EWG und 92/27/EWG über die Etikettierung von Arzneimitteln innerhalb der EU vorgeschrieben. Dexamphetamin ist der INN für (S)-N,α-Methylbenzolethanamin-Enantiomer, das auch als (+)-N,α-Methylphenethylamin bezeichnet wird. Levamphetamin ist das (R)-N,-α-Methylbenzolethanamin-Enantiomer bzw. (–)-N,α-Methylphenethylamin. Weitere gängige chemische Bezeichnungen sind 1-Phenyl-2-aminopropan und Phenylisopropylamin. Zusammen mit Methamphetamin und anderen weniger bekannten Substanzen (z.B. Benzphetamin) fällt Amphetamin mitunter pauschal unter die Gruppe der „Amphetamine“. Es gibt hunderte weitere Synonyme und geschützte Namen (siehe beispielsweise unter http://www.chemindustry.com/chemicals/105322.html). Straßenbezeichnungen sind auch Speed, Base und Whizz.
Analyse
Im Marquis-Feldtest ergibt sich eine orangebraune Färbung. Der Simon-Test liefert eine rote Färbung, die Amphetamine (ein primäres Amin) von sekundären Aminen wie Methamphetamin (blaue Färbung) unterscheidet. Das Massenspektrum zeigt nur geringe Strukturierung mit einem starken Ion bei m/z = 44. Die Identifizierung durch Gaschromatographie und Massenspektrometrie lässt sich durch N-Derivatisierung noch verbessern, etwa durch Verwendung von Schwefelkohlenstoff zur Bildung des Isothiocyanats. Mit Gaschromatographie liegt die Nachweisgrenze im Urin bei <10 μg/l.
Kontrollstatus
Die R- und S-Enantiomere (Levamphetamin bzw. Dexamphetamin) wie auch das Racemate (eine Mischung der R- und S-Stereoisomere im Verhältnis 50:50) sind in Anlage II des Übereinkommens der Vereinten Nationen von 1971 über psychotrope Substanzen verzeichnet.
Medizinische Anwendung
Amphetamin wird gelegentlich therapeutisch zur Behandlung von Narkolepsie und von Aufmerksamkeitsschwäche wegen Hyperaktivität (ADHD) verwendet.
Veröffentlichungen
Multimedia und Infografiken
Quellen
Iversen, L. (2006), Speed, Ecstasy, Ritalin: the Science of Amphetamines, Oxford University Press, Oxford.
King, L. A. und McDermott, S. (2004), ‘Drugs of abuse’, in: Moffat, A. C., Osselton, M. D. und Widdop, B. (eds.) Clarke's Analysis of Drugs and Poisons, 3. Ausgabe, Band 1, S. 37–52, Pharmaceutical Press, London.
Moffat, A. C., Osselton, M. D. und Widdop, B, (eds.) (2004), Clarke's Analysis of Drugs and Poisons, 3. Ausgabe, Band 2, Pharmaceutical Press, London.
Vereinte Nationen (2006), Multilingual Dictionary of Narcotic Drugs and Psychotropic Substances under International Control, United Nations, New York.
Vereinte Nationen(2006), Recommended Methods for the Identification and Analysis of Amphetamine, Methamphetamine and their Ring-Substituted Analogues in Seized Materials (revised and updated), Manual for Use by National Drug Testing Laboratories, United Nations, New York.
Büro der Vereinten Nationen für Drogen- und Verbrechensbekämpfung (2003), Ecstasy and Amphetamines Global Survey 2003, Büro der Vereinten Nationen für Drogen- und Verbrechensbekämpfung, Wien.
Büro der Vereinten Nationen für Drogen- und Verbrechensbekämpfung (2004), Weltdrogenbericht 2004, Band 1: Analysis, Büro der Vereinten Nationen für Drogen- und Verbrechensbekämpfung, Wien.


















